|
SAFETY
MONITORING OF DRUGS RECEIVING PEDIATRIC MARKETING EXCLUSIVITY
Smith PB, Benjamin DK, Murphy MD, et al.
Pediatrics 2008; 122:e628-33
L'articolo mostra le raccomandazioni del PAC riguardanti l'etica della
ricerca e l'informazione sui farmaci pediatrici redatte in risposta ai
report sulla sicurezza della FDA.
RIASSUNTO
OBIETTIVO Il Food and Drug Administration Modernization Act
ha concesso un periodo aggiuntivo di 6 mesi per l'esclusiva di mercato
alle aziende che effettuavano trial su farmaci pediatrici in risposta
ad una richiesta scritta della Food and Drug Administration (FDA).
Poiché molti problemi sulla sicurezza non possono essere individuati
prima dell'immissione di un prodotto su un mercato ampio e diversificato,
il Best Pharmaceuticals for Children Act ha richiesto che la FDA
relazionasse al Pediatric Advisory Committee (PAC) sugli eventi
avversi che occorrevano durante il primo anno dopo la concessione dell'esclusiva.
Si è voluto descrivere le raccomandazioni del Pediatric Advisory
Committee sviluppate in risposta alle review sulla sicurezza basate sui
dati del Food and Drug Administration Adverse Event Reporting System
in 67 farmaci cui è stata concessa l'esclusiva.
PAZIENTI E METODI I convegni del PAC e i dati presentati dalla
FDA per tutti i farmaci sono stati esaminati da giugno 2003 fino ad aprile
2007. I farmaci sono stati divisi in due gruppi: quelli che erano assegnati
al monitoraggio abituale degli eventi avversi e quelli che avevano specifiche
raccomandazioni del PAC.
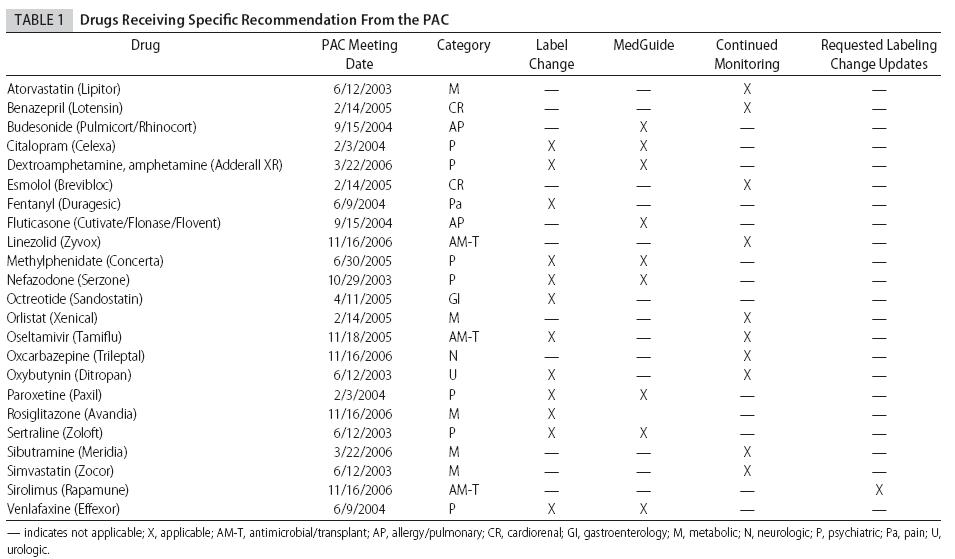
RISULTATI 44 (65,7%) farmaci sono stati riassegnati al monitoraggio
abituale degli eventi avversi. Il PAC, collaborando a volte con altre
commissioni consultive, ha raccomandato la modifica del foglietto illustrativo
per 12 farmaci (17,9%), proseguito il monitoraggio di 10 (14,9%), ha elaborato
le MedGuides per 9 (13,4%), ed ha proposto l'aggiornamento dei cambiamenti
del foglietto illustrativo che risultavano dalla discussione con lo sponsor
per un farmaco (1,5%). Alcuni farmaci sono stati sottoposti a più
di un provvedimento. La maggior parte degli eventi avversi rilevati durante
questa indagine erano rari e pericolosi per la vita.
CONCLUSIONI Il monitoraggio sulla sicurezza durante il periodo
post-marketing è cruciale per individuare gli eventi avversi, rari,
gravi o specifici in pediatria. Fortunatamente, la maggioranza dei farmaci
cui è stata data l'esclusiva non inducevano eventi avversi di frequenza
o severità tali da impedire il ritorno al monitoraggio abituale.
|
